El experimento de Rutherford, también llamado experimento de la lámina de oro, fue realizado por Hans Geiger y Ernest Marsden en 1909, y publicado en 1911 bajo la dirección de Ernest Rutherford en los Laboratorios de Física de la Universidad de Manchester. Los resultados obtenidos y el posterior análisis tuvieron como consecuencia la rectificación del modelo atómico de Thomson (modelo atómico del pudin con pasas) y la propuesta de un modelo nuclear para el átomo.
Accede al VÍDEO explicativo de dicho experimento
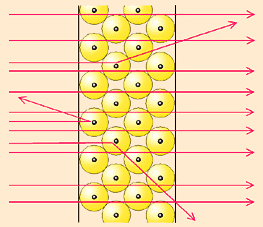
El experimento consistió en bombardear con un haz de partículas alfa una fina lámina de oro y observar cómo las láminas de diferentes metales afectaban a la trayectoria de dichos rayos.
Las partículas alfa se obtenían de la desintegración de una sustancia radiactiva, el polonio. Para obtener un fino haz se colocó el polonio en una caja de plomo, el plomo detiene todas las partículas, menos las que salen por un pequeño orificio practicado en la caja. Perpendicular a la trayectoria del haz se interponía la lámina de metal. Y, para la detección de trayectoria de las partículas, se empleó una pantalla con sulfuro de zinc que produce pequeños destellos cada vez que una partícula alfa choca con él. Según el modelo de Thomson, las partículas alfa atravesarían la lámina metálica sin desviarse demasiado de su trayectoria:
Pero se observó que un pequeño porcentaje de partículas se desviaban hacia la fuente de polonio, aproximadamente una de cada 8.000 partícula al utilizar una finísima lámina de oro con unos 200 átomos de espesor. En palabras de Rutherford ese resultado era "tan sorprendente como si le disparases balas de cañón a una hoja de papel y rebotasen hacia ti".
Rutherford concluyó que el hecho de que la mayoría de las partículas atravesaran la hoja metálica, indica que gran parte del átomo está vacío, que la desviación de las partículas alfa indica que el deflector y las partículas poseen carga positiva, pues la desviación siempre es dispersa. Y el rebote de las partículas alfa indica un encuentro directo con una zona fuertemente positiva del átomo y a la vez muy densa.
Pero se observó que un pequeño porcentaje de partículas se desviaban hacia la fuente de polonio, aproximadamente una de cada 8.000 partícula al utilizar una finísima lámina de oro con unos 200 átomos de espesor. En palabras de Rutherford ese resultado era "tan sorprendente como si le disparases balas de cañón a una hoja de papel y rebotasen hacia ti".
Rutherford concluyó que el hecho de que la mayoría de las partículas atravesaran la hoja metálica, indica que gran parte del átomo está vacío, que la desviación de las partículas alfa indica que el deflector y las partículas poseen carga positiva, pues la desviación siempre es dispersa. Y el rebote de las partículas alfa indica un encuentro directo con una zona fuertemente positiva del átomo y a la vez muy densa.
El modelo atómico de Rutherford mantenía el planteamiento de Thomson, de que los átomos poseen electrones, pero su explicación sostenía que todo átomo estaba formado por un núcleo y una corteza. El núcleo debía tener carga positiva, un radio muy pequeño y en él se concentraba casi toda la masa del átomo. La corteza estaría formada por una nube de electrones que orbitan alrededor del núcleo.
Según Rutherford, las órbitas de los electrones no estaban muy bien definidas y formaban una estructura compleja alrededor del núcleo, dándole un tamaño y forma indefinida. También calculó que el radio del átomo, según los resultados del experimento, era diez mil veces mayor que el núcleo mismo, lo que implicaba un gran espacio vacío en el átomo.