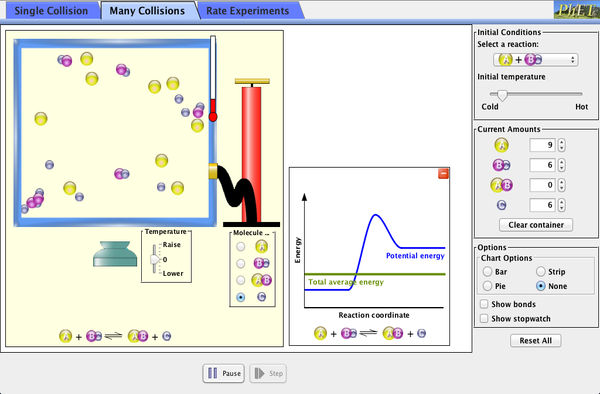
En la siguiente simulación podrás estudiar el efecto de la temperatura, de la concentración de reactivo y un catalizador en la velocidad de una reacción química. (Nota: esta simulación se descarja y dr ejecuta con una versión actualizada de Java)
16 abril 2017
Simulaciones: Ajuste de reaccciones y cálculos estequiométricos
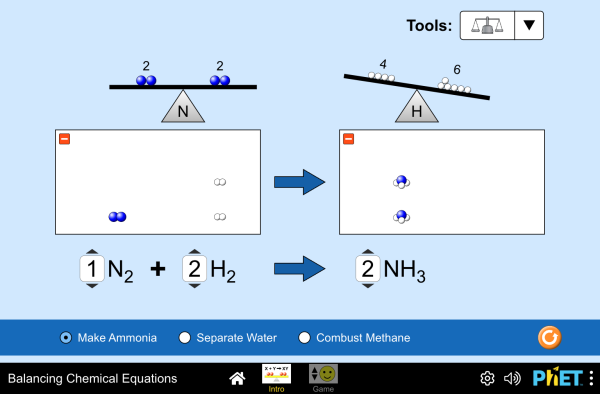
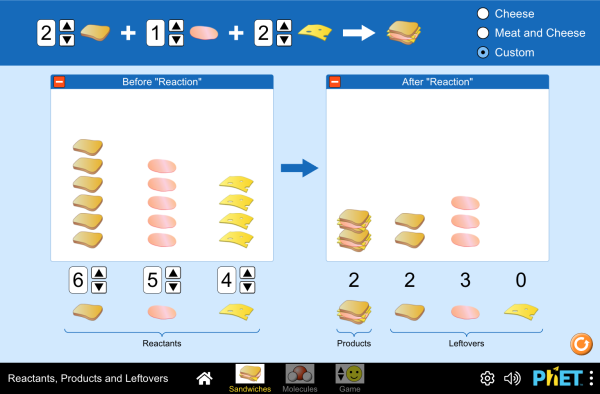
Para practicar el ajuste de las reacciones químicas y para comprender cómo es la proporción de las sustancias que reaccionan teniendo en cuenta la cantidad de productos y reactivos que hay al finalizar la reacción, tienes las dos simulaciones siguientes:
Si quieres acceder a pantalla completa, pulsa en las imágenes siguientes:
Tarea 3.2 Cálculos químicos: estequiometría
Vas a realizar ejercicios de CÁLCULOS ESTEQUIOMÉTRICOS masa-masa y con reactivos en disolución (opcional, cálculos de reacciones entre gases). Para ello, debes tener en cuenta:
- Debes saber escribir la ECUACIÓN QUÍMICA (formulaciones) y AJUSTARLA.
- Para los cálculos utilizamos los COEFICIENTES ESTEQUIOMÉTRICOS, que relacionan la cantidad de sustancia, tanto de reactivos como productos.
Actividad 23.- El clorato de potasio, KClO3, se descompone en cloruro de potasio, KCl, y oxígeno, O2. Calcula la masa de oxígeno que se obtiene al descomponerse 86,8 g de clorato de potasio por la acción del calor. Datos: K= 39,1 g·mol-1; Cl= 35,5 g·mol-1; O= 16,0 g·mol-1. Sol: 33,984 g
Actividad 24.- Calcula el volumen de una disolución de ácido clorhídrico 0,2 M necesario para que reaccionen completamente 250 mL de una disolución de hidróxido de calcio 0,1 M. Los productos de esta reacción química son cloruro de calcio y agua. Sol: 250 mL
Actividad 25.- Calcula la cantidad de sustancia de PCl3 que se obtiene si reaccionan 426 g de Cl2 según la reacción Cl2 + P4 → PCl3 Sol: 4 mol
Actividad 26.- Calcula la cantidad de sustancia de P4 que es necesaria en la reacción de la actividad anterior. Sol: 1 mol
Actividad 27.- Se hace reaccionar carbonato de calcio con ácido clorhídrico según la siguiente reacción CaCO3 + 2 HCl → CaCl2 + H2O + CO2
Calcula la masa de cloruro de calcio que se obtiene a partir de 250 g de carbonato de calcio.
Sol: 388,5 g de CaCl2
Actividad 28.- ¿Qué volumen de ácido clorhídrico se necesita en la reacción anterior suponiendo condiciones normales? Sol: 156,8 L
Actividad 29.- Calcula el volumen necesario de una disolución de ácido clorhídrico 2,5 M para que reaccionen 0,2 mol de cinc según esta reacción. Zn + 2 HCl → ZnCl2 + H2 Sol: 160 mL
Actividad 30.- Calcula el volumen de disolución de ácido clorhídrico del ejercicio 24 si la concentración de este reactivo fuera de 0,1 M. ¿Cuál es la relación entre ambos resultados?
Sol: 250 mL
ACTIVIDADES COMPLEMENTARIAS
C1.- Aprende a resolver problemas de estequiometría: Sigue las orientaciones que figuran en e libro (página 137): 1) Entiende el enunciado y extrae datos, 2) Ajuste de la reacción química, 3) Identifica las leyes y ecuaciones que intervienen. 4) Obtén el resultado, realizando los cálculos necesarios, y analiza su validez.
C2..- Trabaja con las TICs: Utiliza las simulaciones para ajustar reacciones químicas, cálculos estequiométricos y velocidad de reacción: En el libro (página 138-139) tienes las explicaciones de cómo debes usarla. En el blog encuentras las simulaciones:
http://flipoporfisicayquimica.blogspot.com.es/2017/04/simulaciones-ajuste-de-reaccciones-y.html
http://flipoporfisicayquimica.blogspot.com.es/2017/04/simulacion-sobre-la-velocidad-de.html
C3.- Estudia las ideas clave: En el libro (página 140), en la sección denominada Taller de ciencias, puedes hacer una autoevaluación de tus conocimientos, repasando las ideas clave y organizando tus ideas (has un resumen, un esquema conceptual, utiliza dibujos y gráficos….
Actividad 26.- Calcula la cantidad de sustancia de P4 que es necesaria en la reacción de la actividad anterior. Sol: 1 mol
Actividad 27.- Se hace reaccionar carbonato de calcio con ácido clorhídrico según la siguiente reacción CaCO3 + 2 HCl → CaCl2 + H2O + CO2
Calcula la masa de cloruro de calcio que se obtiene a partir de 250 g de carbonato de calcio.
Sol: 388,5 g de CaCl2
Actividad 28.- ¿Qué volumen de ácido clorhídrico se necesita en la reacción anterior suponiendo condiciones normales? Sol: 156,8 L
Actividad 29.- Calcula el volumen necesario de una disolución de ácido clorhídrico 2,5 M para que reaccionen 0,2 mol de cinc según esta reacción. Zn + 2 HCl → ZnCl2 + H2 Sol: 160 mL
Actividad 30.- Calcula el volumen de disolución de ácido clorhídrico del ejercicio 24 si la concentración de este reactivo fuera de 0,1 M. ¿Cuál es la relación entre ambos resultados?
Sol: 250 mL
ACTIVIDADES COMPLEMENTARIAS
C1.- Aprende a resolver problemas de estequiometría: Sigue las orientaciones que figuran en e libro (página 137): 1) Entiende el enunciado y extrae datos, 2) Ajuste de la reacción química, 3) Identifica las leyes y ecuaciones que intervienen. 4) Obtén el resultado, realizando los cálculos necesarios, y analiza su validez.
C2..- Trabaja con las TICs: Utiliza las simulaciones para ajustar reacciones químicas, cálculos estequiométricos y velocidad de reacción: En el libro (página 138-139) tienes las explicaciones de cómo debes usarla. En el blog encuentras las simulaciones:
http://flipoporfisicayquimica.blogspot.com.es/2017/04/simulaciones-ajuste-de-reaccciones-y.html
http://flipoporfisicayquimica.blogspot.com.es/2017/04/simulacion-sobre-la-velocidad-de.html
C3.- Estudia las ideas clave: En el libro (página 140), en la sección denominada Taller de ciencias, puedes hacer una autoevaluación de tus conocimientos, repasando las ideas clave y organizando tus ideas (has un resumen, un esquema conceptual, utiliza dibujos y gráficos….
C4.- Refuerza tus conocimientos haciendo ejercicios: En el libro (páginas 142-143-144) tienes bastantes ejercicios para reforzar la unidad. Son muchos, por eso, te propongo los siguientes: 2, 3, 5, 6, 7, 10, 13, 17, 18, 19, 20, 22, 25, 26, 28, 31.
05 abril 2017
Vídeos: Moles y Número de Avogadro
Para empezar, un vídeo sobre el concetpo de MOL. La unidad que mide la cantidad de sustancia en química.
En este vídeo te expican el concepto de MOL y cómo se obtiene el número de moléculas, átomos totales, átomos de hidrogeno y átomos de oxígeno presentes en 72 gramos de agua.
MOLES DE ÁTOMOS Y MOLES DE MOLÉCULAS
Amadeo Avogadro, la hipótesis (ley) de Avogadro y el número de Avogadro
Químico y físico italiano. Nació el 9 de junio de 1776 en Turín, Italia y murió el 9 de julio de 1856.
En 1792 se graduó como doctor en derecho canónico, pero no ejerció. En vez de ello, mostró verdadera pasión por la física y la química, y una gran destreza para las matemáticas.
Recapacitando sobre el descubrimiento de Charles (publicado por Gay -Lussac) de que todos los gases se dilatan en la misma proporción con la temperatura decidió que esto debía implicar que cualquier gas a una temperatura dada debía contener el mismo número de partículas por unidad de volumen. Avogadro tuvo la precaución de especificar que las partículas no tenían por qué ser átomos individuales sino que podían ser combinaciones de átomos (lo que hoy llamamos moléculas).
Con esta consideración pudo explicar con facilidad la ley de la combinación de volúmenes que había sido anunciada por Gay-Lussac y, basándose en ella, dedujo que el oxígeno era 16 veces más pesado que el hidrógeno y no ocho como defendía Dalton en aquella época.
Enunció la llamada hipótesis de Avogadro: iguales volúmenes de gases distintos contienen el mismo número de moléculas, si ambos se encuentran a igual temperatura y presión.
Ese número, equivalente a 6,022· 1023, es constante, según publicó en 1811. Como ha ocurrido muchas veces a lo largo de la historia las propuestas de Avogadro no fueron tomadas en cuenta, es más, Dalton, Berzelius y otros científicos de la época despreciaron la validez de su descubrimiento y la comunidad científica no aceptó de inmediato las conclusiones de Avogadro por tratarse de un descubrimiento basado en gran medida en métodos empíricos y válido solamente para los gases reales sometidos a altas temperaturas pero a baja presión.
Sin embargo, la ley de Avogadro permite explicar por qué los gases se combinan en proporciones simples.
Fue su paisano Cannizaro quién, 50 años más tarde, se puso a su favor y la hipótesis de Avogadro empezó a ser aceptada. A partir de entonces empezó a hablarse del número Avogadro.
En 1792 se graduó como doctor en derecho canónico, pero no ejerció. En vez de ello, mostró verdadera pasión por la física y la química, y una gran destreza para las matemáticas.
Recapacitando sobre el descubrimiento de Charles (publicado por Gay -Lussac) de que todos los gases se dilatan en la misma proporción con la temperatura decidió que esto debía implicar que cualquier gas a una temperatura dada debía contener el mismo número de partículas por unidad de volumen. Avogadro tuvo la precaución de especificar que las partículas no tenían por qué ser átomos individuales sino que podían ser combinaciones de átomos (lo que hoy llamamos moléculas).
Con esta consideración pudo explicar con facilidad la ley de la combinación de volúmenes que había sido anunciada por Gay-Lussac y, basándose en ella, dedujo que el oxígeno era 16 veces más pesado que el hidrógeno y no ocho como defendía Dalton en aquella época.
Enunció la llamada hipótesis de Avogadro: iguales volúmenes de gases distintos contienen el mismo número de moléculas, si ambos se encuentran a igual temperatura y presión.
Ese número, equivalente a 6,022· 1023, es constante, según publicó en 1811. Como ha ocurrido muchas veces a lo largo de la historia las propuestas de Avogadro no fueron tomadas en cuenta, es más, Dalton, Berzelius y otros científicos de la época despreciaron la validez de su descubrimiento y la comunidad científica no aceptó de inmediato las conclusiones de Avogadro por tratarse de un descubrimiento basado en gran medida en métodos empíricos y válido solamente para los gases reales sometidos a altas temperaturas pero a baja presión.
Sin embargo, la ley de Avogadro permite explicar por qué los gases se combinan en proporciones simples.
Fue su paisano Cannizaro quién, 50 años más tarde, se puso a su favor y la hipótesis de Avogadro empezó a ser aceptada. A partir de entonces empezó a hablarse del número Avogadro.
RECURSOS PARA APRENDER MÁS SOBRE AVOGADRO Y EL NÚMERO DE AVOGADRO
- RTVE: Avogadro, el gran científico italiano del siglo XIX (Texto y postcast del programa de RNE "A hombros de gigantes")
Suscribirse a:
Entradas (Atom)