Los siguientes enlaces pueden ayudarte a entender mejor algunas cuestiones del enlace químico.
1.- ENLACE Y ESTABILIDAD
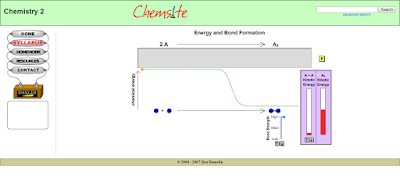
En esta página web (en inglés) encontrarás una animación/simulación en la que se muestra la disminución de energía y, por tanto, el aumento de estabilidad que sufren los átomos al enlazarse.
En función de la fuerza de enlace que se forma el sistema enlazado será más o menos estable. Cuanto menos energía tenga el sistema, posiciones inferiores del gráfico, más estable.
Para ver la animación modifica los parámetro de Fuerza de enlace (Bond Strenght) y Energía de enlace (Kinetic Energy) con las flechas correspondientes y pulsa el pequeño recuadro verde superior. El cambio de energía química (chemical energy) se marcará con el movimiento del punto naranja.
En el recuadro gris grande que aparece en la parte superior, encima de la gráfica, a la vez que se produce el cambio de energía se simula el choque de los dos átomos aislados y la formación del enlace entre ellos.
HAZ CLIC SOBRE LA IMAGEN PARA ACCEDER AL ENLACE
2.- DIAGRAMA DE LEWIS
En esta animación podrás representar diagramas de Lewis con enlaces sencillos, dobles y triples. En la petaña enlaces (Simple Bonds), podrás construir directamente los compuestos con enlaces sencillos que aparecen en el recuadro gris arrastrando los correspondientes átomos al cuadrado verde. Mueve los electrones de sitio pulsando sobre ellos. Para comprobar los resultados pulsa sobre la fórmula del compuesto y el diagrama de Lewis correcto aparecerá en el cuadro negro.
En las pestañas de los enlaces dobles y triples, Double bonds y Triple bonds, respectivamnete, pulsando sobre la fórmula verás una animación en la que se enlazan los átomos mediante un enlace sencillo. Para formar el doble pulsar una segunda vez sobre la fórmula. El triple enlace se formará pulsando tres veces la fórmula.
Puedes acceder a la animación en pantalla completa
AQUÍ