Accede a los siguientes enlace para ampliar y profundizar en el estudio del enlace quimico.
Enlace al blog EUREKA
Características de los enlaces ACCEDE AQUÍ
ENLACE IÓNICO
Construyemdo moléculas mediante DIAGRAMA DE LEWIS
Accede a un documento bastante amplio (en aglunas cuestiones con un nivel superior a 4º ESO:
ENLACE QUÍMICO
28 noviembre 2016
UD 2 Enlace químico y fuerzas intermoleculares. Tarea 1
LO QUE DEBES SABER, LO QUE DEBES REPASAR
1.- Los gases nobles son los únicos elementos químicos cuyos átomos se presentan aislados.
2.- El enlace químico se da entre átomos o iones: entre iones (iónico), entre átomos (covalente) y entre restos catiónicos (metálico)
3.- Todas las sustancias compuestas o son cristales o moléculas.
4.- Los cristales pueden ser iónicos, covalentes o metálicos.
5.- Las moléculas solo se forman mediante enlace covalente, y se da entre elementos no metálicos.
6.- Pueden darse enlace entre moléculas, que se denomina fuerzas intermoleculares, y que son de gran importancia en muchos compuestos biológicos.
13 noviembre 2016
Espectros atómicos, configuraciones electrónicas y Tabla Periódica
En el siguiente enlace tienes una simulación muy completa que te ayudará a entender la relación que hay entre las configuraciones electrónicas y el lugar que ocupa un elemento en la Tabla Periódica.
10 noviembre 2016
La nueva canción de la Tabla Periódica
Los youtubers canadienses Mitchell Moffit and Gregory Brown han creado el canal AssapSCIENCE, dedicado a temas científicos. Tienes que activar los subtítulos en español.
09 noviembre 2016
Simulaciones: Tabla Periódica dinámica y Propiedades Periódicas
La siguiente simulación te ayudará a entender y estudiar la Tabla Periódica. Haz clic sobre la imagen.
La siguiente simulación está en inglés, y es de un nivel alto. No obstante, hay algunas cuestiones que te ayudarán a entender las PROPIEDADES PERIÓDICAS.
Puedes acceder a la animación en pantalla completa AQUÍ
La siguiente simulación está en inglés, y es de un nivel alto. No obstante, hay algunas cuestiones que te ayudarán a entender las PROPIEDADES PERIÓDICAS.
Recursos para estudiar el Sistema Periódico de los Elementos
En los siguientes enlaces podrás estudiar y apr las propiedades periódicas:
ESTUDIA Y APRENDE LA T.P. Y LAS PROPIEDADES PERIÓDICAS
Acede a una Tabla Periódica muda, donde podrás a familiarizarte con la misma:
ESTUDIA Y APRENDE LA T.P. Y LAS PROPIEDADES PERIÓDICAS
Acede a una Tabla Periódica muda, donde podrás a familiarizarte con la misma:
07 noviembre 2016
UD 1 Tarea 2.- El Sistema Periódico y las configuraciones electrónicas
ACTIVIDAD DE ESTUDIO.- Para esta tarea es fundamental que conozcas:
a) La clasificación de los elementos en 7 períodos y 18 grupos o familias. Nombre de los elementos y su lugar en la tabla periódica.
b) Propiedades periódicas: distinguir metales, no metales, metaloides y gases nobles. Algunas propiedades periódicas: afinidad electrónica, energía de ionización, radio atómico.
c) ¿Qué relación hay entre el sistema periódico y las configuraciones electrónicas de los elementos? Distingue elementos por bloques (s, p, d y f) y por sus electrones de valencia.
d) Las masas atómicas de los elementos y su cálculo, a partir de la abundancia relativa de sus isótopos.
RESPONDE A LAS SIGUIENTES ACTIVIDADES EN TU CUADERNO:
Actividad 18.- Clasifica los elementos, según sean metales, no metales, semimetales o gases nobles: potasio, hierro, argón, cloro, teluro, molibdeno, radón, silicio, paladio, bario, flúor.
Actividad 19.- Ordena estos elementos por su afinidad electrónica creciente: Se, Ga, Br y Cu, todos del período 4.
Actividad 20.- ¿Qué elementos tendrían una energía de ionización baja? ¿Y muy alta?
Actividad 21.- Escribe las configuraciones electrónicas de estos elementos representativos e indica su posición en la tabla periódica: potasio (Z= 19), neón (Z= 10), aluminio (Z= 13) y azufre (Z= 16).
Actividad 22.- Escribe las configuraciones electrónicas de los átomos acortada e indica los electrones de valencia del fósforo (Z= 15), estaño (Z= 50), yodo (Z= 53) y francio (Z= 87). Indica luego, cuales tendrán a formar cationes y cuáles aniones.
Actividad 24.- Indica el nombre y el simbolo de los elementos cuyos electrones de valencia son: a) 3s2 3p2; b) 2s2; c) 4s2 4p5; d) 3s2 3p6.
Actividad 23.- El elemento de configuración electrónica terminada en 4s2 3d6. ¿es metal, no metal o gas noble?.
Actividad 24.- Indica el nombre y el simbolo de los elementos cuyos electrones de valencia son: a) 3s2 3p2; b) 2s2; c) 4s2 4p5; d) 3s2 3p6.
Actividad 25.- El boro tiene dos isótopos estables, B-10 y B-11. Utilizando la definición de masa teórica del átomo, y sabiendo que las abundancias relativas de estos isótopos son 19,78% y 80,22%, respectivamente, calcula la masa atómica promedio.
ACTIVIDAD DE INVESTIGACIÓN.-
Exposición de motivos: La tabla periódica de Mendeléyev presentaba un problema, y eran las irregularidades que existían para compaginar el criterio de ordenación por masa o peso atómico creciente y la agrupación por familias con propiedades químicas comunes. Durante algún tiempo, esta cuestión no pudo resolverse satisfactoriamente hasta que Henry Moseley (1867-1919) realizó un estudio sobre los espectros de rayos X en 1913. Moseley comprobó que al representar la raíz cuadrada de la frecuencia de la radiación en función del número de orden en el sistema periódico se obtenía una recta, lo cual permitía pensar que este orden no era casual sino reflejo de alguna propiedad de la estructura atómica. Hoy sabemos que esa propiedad es el número atómico (Z).
Investiga: a) La biografía de Henry Moseley y sus trabajos que le permitieron obtener la ley periódica, confirmada posteriormente por la mecánica cuántica, lo que nos permite aceptar que la ordenación de los elementos en el sistema periódico está relacionada con la estructura electrónica de los átomos de los diversos elementos. a partir de la cual se pueden predecir sus diferentes propiedades químicas.
b) Los trabajos de Glenn Seaborg, en 1945, que le valió el Premio Nobel de Química en 1951.
31 octubre 2016
Simulaciones: Configuraciones electrónicas
Accede a las siguientes simulaciones donde podrás estudiar las configuraciones electrónicas de los elemenos.
 CONFIGURACIONES ELECTRÓNICAS DE LOS ELEMENTOS
CONFIGURACIONES ELECTRÓNICAS DE LOS ELEMENTOS
EJERCICIOS DE CONFIGURACIONES ELECTRÓNICAS
 CONFIGURACIONES ELECTRÓNICAS DE LOS ELEMENTOS
CONFIGURACIONES ELECTRÓNICAS DE LOS ELEMENTOSEJERCICIOS DE CONFIGURACIONES ELECTRÓNICAS
UD 1 Tarea de aprendizaje.- El modelo cuàntico del átomo y las configuraciones electrónicas
El modelo actual del átomo es el denominado modelo cuántico o mecano-cuántico. Introduce el concepto de orbital atómico. Sus antecedentes se basan en el la hipótesis de De Broglie, la teoría cuántico de Planck y el principio de incertidumbre de Heisenbberg, Con esta base se han determinados unas ecuaciones de onda (ecuación de Schrodinger), que son los que constituye los orbitales atómicos.
Hay cuatro tipos de orbitales, s (sharp), p (principal), d (difusse) y f (fundamental).
Hay cuatro tipos de orbitales, s (sharp), p (principal), d (difusse) y f (fundamental).
En cada nivel de energía, y en cada orbital hay un número máximo de electrones. La distribución energética de los orbitales sigue la llamada regla o diagrama de Moeller, que se basa en unas reglas de llenado:
a) los orbitales atómicos se llenan de menor a mayor energía;
b) al completar los orbitales del mismo valor de energía, comenzará el llenado de los siguientes; y
c) Los electrones ocupan el mayor número posible de orbitales de la misma energía (máxima multiplicidad).
CONFIGURACIONES ELECTRONICAS
Para el elemento Oxígeno, su configuración es: [O]= 1s2
2s2
2p4
El número indica el nivel de energía, a continuación los orbitales para el respectivo nivel. Y el superíndice indica el número de electrones totales que hay en cada orbital.
Para el Germanio (Z= 32). [Ge]= 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p2
Para el Germanio (Z= 32). [Ge]= 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p2
Los electrones del último nivel se denominan electrones de valencia. El Oxígeno tiene 6 electrones de valencia, y el Germanio tendría 4 electrones de valencia (4s2
4p2)
Actividad 12.- Haz una tabla indicando los niveles de energía, y los orbitales y tipo de orbitales con el número máximo de electrones para cada nivel.
Actividad 13.- Indica cuántos electrones tiene un átomo si su configuración electrónica es 1s2 2s2 2p6 3s2.
Actividad 14.- Indica los orbitales ocupados en el último nivel de energía de un átomo cuya configuración electrónica es: 1s2 2 s2 2p6 3s2 3p3
Actividad 15.- Explica por qué es posible tener 2 electrones en un orbital 2s y 6s en el orbital 2p.
Actividad 16.- Escribe las configuraciones electrónicas de los átomos neutros: litio (Z= 3), potasio (Z= 11), flúor (Z= 9), cloro (Z= 17), bromo (Z= 35). ¿Qué observas respecto al último nivel?
Actividad 17.- Escribe la configuración electrónica del catión Li+ y el anión F-
28 octubre 2016
Resumen Modelos atómicos (Simulaciones)
Tienes dos simulaciones, a modo de resumen, para repasar los modelos atómicos (desde Thomson hasta el modelo cuántico).
La primera simulación es del IES Aguilar y Cano, haciendo clic sobre la imagen
La segunda simulación tiene contenidos de bachillerato. Sin embargo, hay algunas cuestiones que te ayudarán a tener una visión comparativa y evolutiva de los modelos atómicos.
Puedes ver ambas simulaciones en PANTALLA COMPLETA:
SIMULACIÓN DEL IES AGUILAR Y CANO
SIMULACIÓN MODELOS ATÓMICOS
La primera simulación es del IES Aguilar y Cano, haciendo clic sobre la imagen
La segunda simulación tiene contenidos de bachillerato. Sin embargo, hay algunas cuestiones que te ayudarán a tener una visión comparativa y evolutiva de los modelos atómicos.
SIMULACIÓN DEL IES AGUILAR Y CANO
SIMULACIÓN MODELOS ATÓMICOS
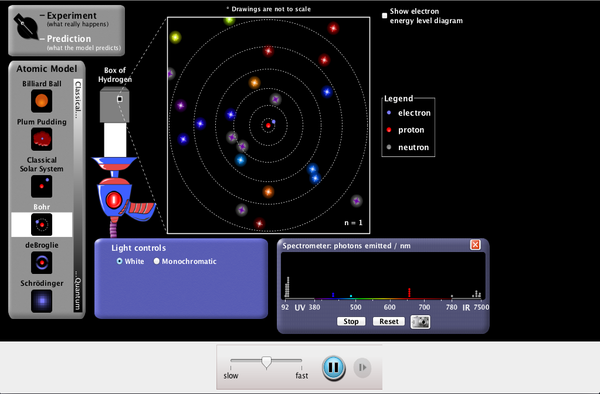
Mas Simulaciones del Modelo atómico de Bohr
Haciendo clic en los enlaces y/o en la imagen podrás acceder a simulaciones del modelo atómico de Bohr:
Modelo atómico de Bohr (IES Aguilar y Cano)
(Simulación del IES Aguilar y Cano, de Sevilla, del profesor Salvador Hyratado)

Modelo de Bohr (Fisquiweb) (Simulación de la web www.fisquiweb.com con una explicacion más detallada de la relación del modelo con el espectro de hidrógeno)
Suscribirse a:
Entradas (Atom)